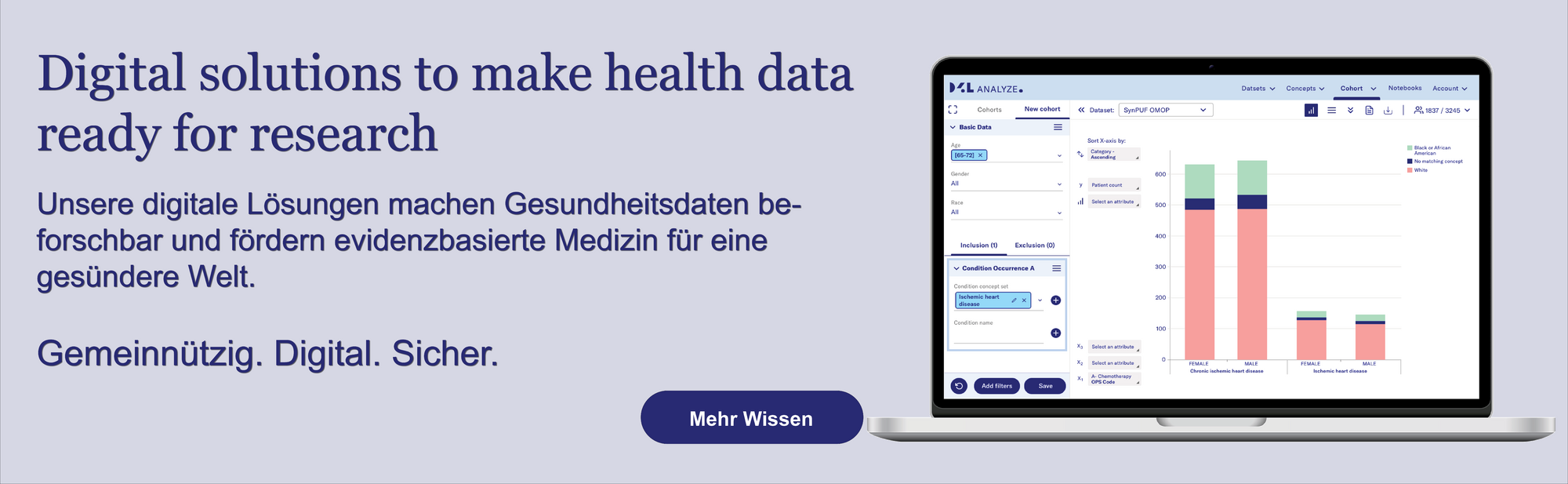
1. Datenschutz bei Patientendaten
Bei jedem Arztbesuch entstehen Daten. Dies können Angaben zur Erkrankung, zu früheren Behandlungen, zu Laborergebnissen und vielem mehr sein [1-3].
Natürlich haben all diese Informationen eine ganz unmittelbare Relevanz für die behandelnden Ärzt:innen sowie Patient:innen. Schließlich fußen hierauf alle Entscheidungen zum weiteren Vorgehen [1-3].
Patientendaten
= alle Informationen zur Person, die anlässlich einer Untersuchung und Behandlung genutzt werden
Beispiele:
- Daten aus Arztbriefen
- Daten aus der Krankengeschichte
- Daten aus medizinischen Untersuchungen (Blutdruckmessungen, Röntgenbilder, Laborergebnisse etc.)
- Daten aus dem Arzt-Patienten-Gespräch
Doch darüber hinaus besteht unter Wissenschaftler:innen große Einigkeit, dass all diese Patientendaten – richtig genutzt – noch einen weit größeren, über das Individuum hinausgehenden Beitrag leisten könnten [1].
Dies würde gelingen, wenn man die anfallenden Daten aus der Patientenversorgung mit den im Alltag – beispielsweise über Wearables – erfassten Real-World-Daten zusammenbringt und dann entsprechend mit der medizinischen Forschung vernetzt [1].
Diese bisher teils noch parallel existierenden „Datenwelten” würden so vereint werden – mit dem entscheidenden Vorteil eines noch größeren Erkenntnisgewinns, vermehrter Krankheitsprävention und einer damit insgesamt besseren Gesundheit für alle [1].
Damit all dies gelingt, bleibt die Kombination aus innovativen digitalen Lösungen und hochwertigem Datenschutz jedoch unverzichtbar. Denn nur wenn die nötige Sicherheit gewährleistet ist, werden Patient:innen einwilligen, ihre Daten zur Verfügung zu stellen bzw. weiterzugeben [1, 4].
1.1. Die Patienteneinwilligung – Eine Definition
Der Begriff Patienteneinwilligung hängt vom jeweiligen Kontext ab:
Im Krankenhaus- und Praxisalltag handelt es sich bei der Patienteneinwilligung klassischerweise um die nötige Zustimmung vor der Durchführung eines medizinischen Eingriffs, nachdem Ärzt:innen ihre Patient:innen darüber ausreichend aufgeklärt haben [5].
Dadurch wird Patient:innen eine fundierte Aufklärung über Art, Umfang, Durchführung, Risiken, Notwendigkeit, Dringlichkeit, Eignung, Erfolgsaussichten und Behandlungsalternativen einer anstehenden medizinischen Maßnahme rechtlich zugesprochen und garantiert [5].
Für die Forschung kommt dem Begriff der Patienteneinwilligung dementsprechend – kontextbedingt – eine andere Bedeutung zu [2, 3]:
Hier handelt es sich um eine freiwillige (und später widerrufbare) Einwilligung in die Nutzung von Patientendaten für medizinische Forschungszwecke [2, 3].
In diesem Artikel geht es ausschließlich um Zweiteres, also die breite Patienteneinwilligung im Rahmen von Forschungszwecken. Idealerweise werden hierfür folgende Schritte durchlaufen [2, 3]:
- Ein/e Patient:in wird in einer medizinischen Einrichtung ärztlich behandelt.
- Im Rahmen der Behandlung werden Patientendaten erhoben (z.B. im Rahmen von Blutentnahmen, Biopsien oder operativen Eingriffen).
- Personal der Einrichtung bittet den/die Patient:in, Ihre Patientendaten für medizinische Forschungszwecke zur Verfügung zu stellen.
- Eine offizielle Aufklärung und Einwilligung erfolgt.
- Die gewonnenen Patientendaten werden in einer Datenbank gesammelt.
- Die Patientendaten können – unter strengen Kriterien – für die medizinische Forschung genutzt werden.
- Die Früherkennung, Behandlung und Vorbeugung von Krankheiten kann dadurch fortlaufend verbessert werden.
Grundsätzliches Prinzip der Patienteneinwilligung ist also, dass die Einwilligung informiert erfolgt. Sie sollte also ausreichend präzise Informationen darüber enthalten, welche Stelle für welche Zwecke mit welchen Daten forschen können soll [6].
Dabei besteht jedoch eine wesentliche Herausforderung. Schließlich ist der Wert von Patientendaten für künftige wissenschaftliche Erkenntnisse dauerhaft. Für die Wissenschaft verlieren die Daten über die Jahre somit keineswegs an Wert [6].
Vielmehr ist zum Zeitpunkt der Datenerhebung oft gar nicht absehbar, welche wissenschaftlichen Fragestellungen sich im weiteren Verlauf ergeben könnten. Dies ist der Grund, weswegen das Prinzip des sogenannten „Broad Consent” in der medizinischen Forschung immer wichtiger wird [6].
1.2. „Broad Consent”-Patienteneinwilligung in Deutschland
Beim „Broad Consent” bzw. der „Broad Consent”-Patienteneinwilligung handelt es sich – wie der Name suggeriert – um eine „breite Zustimmung” zur Datenverarbeitung für Forschungszwecke. Die Patienteneinwilligung ist also umfassender sowie allgemeiner formuliert und damit weniger an ein einzelnes, gegenwärtiges Forschungsprojekt geknüpft [6].
Bei der Umsetzung dieses Prinzips warteten auf Deutschland als Forschungsstandort gleich mehrere Hürden:
Zunächst einmal bestehen zahlreiche organisatorische Herausforderungen aufgrund von verschiedenen behördlichen Zuständigkeiten zwischen Bund und Ländern. So können bei bundesweiten Verbundprojekten bis zu 17 verschiedene Datenschutzbehörden involviert sein. Deren Auslegung des Datenschutzrechts kann durchaus unterschiedlich ausfallen, was dann viel Koordinationsaufwand mit sich bringt [6].
Gleichzeitig kann es ausgesprochen schwierig sein, eine Patienteneinwilligung ausreichend „informiert” zu gestalten („Ihre Daten werden für Folgendes genutzt”) und gleichzeitig – im Sinne eines Broad Consents – eine Unbestimmtheit der Datenverarbeitung zu ermöglichen. Also die Daten auch zu einem späteren, noch unbekannten Anlass nutzen zu können [6].
Auch war es wichtig, bei der Umsetzung unbedingt gleiche Standards zu ermöglichen. Würde nämlich jedes Forschungsinstitut eine andere Art der Patienteneinwilligung einholen, wäre es schwierig, die Daten deutschlandweit einheitlich für Forschungsfragen nutzen zu können [2].
Um die Voraussetzung für eine deutschlandweit einheitliche Nutzungsmöglichkeit der Daten für medizinische Forschungsfragestellungen zu schaffen, wurde daher die sogenannte Medizininformatik-Initiative ins Leben gerufen – mit Erfolg [1].
1.2.1. Die Medizininformatik-Initiative
Die Medizininformatik-Initiative (MII) ist ein bundesweites, vom Bundesministerium für Bildung und Forschung (BMBF) gefördertes Projekt, in dem Wissenschaftler:innen aus Medizin, Informatik und weiteren Fachrichtungen zusammenarbeiten [1].
Erklärtes Ziel ist, „Patientendaten, die während eines Klinikaufenthalts entstehen, bundesweit digital zu vernetzen.” Die MII ist also der wesentliche Antreiber, wenn es darum geht, die Patientenversorgung besser mit der medizinischen Forschung zu verknüpfen [1].
Die Initiative hat dabei bereits wesentliche Erfolge erreicht:
1.2.2. Broad Consent und die DSGVO
So hat die Konferenz der unabhängigen Datenschutzbeauftragten des Bundes und der Länder am 15.4.2020 ihr Einverständnis zu einem bundesweit einheitlichen Mustertext für die Patienteneinwilligung gegeben [2, 7].
Dies ist deswegen so bedeutend, weil es der medizinischen Forschung dadurch fortan möglich ist, auf Basis der EU-Datenschutzgrundverordnung (DSGVO) bundesweit eine breite Patienteneinwilligung (Broad Consent) für die Nutzung von Patientendaten einzuholen [7].
Damit konnte dem Problem mit der fehlenden Einheitlichkeit erfolgreich begegnet werden. Ein riesiger Meilenstein für die gesamte standortübergreifende medizinische Forschung [2, 7].
Und auch für Patient:innen bedeutet dies mehr Transparenz und eine Stärkung ihrer Autonomie. Schließlich ist die Einwilligung in den Mustertext (siehe unten) stets freiwillig und enthält alle relevanten Informationen zum Umgang mit den Patientendaten [7].
Auch gibt es begleitend dazu ein zentrales Onlineangebot, mit dem die Öffentlichkeit über alle aktuellen – auf den Patientendaten basierenden – Forschungsvorhaben informiert wird [7].
Laut Experten bedeutet dies, dass „die Gesellschaft live erlebt, wie ein lernendes Gesundheitssystem funktioniert”. Ohne das Broad-Consent-Prinzip wäre dies nicht möglich gewesen [7].
2. Muster zur Einwilligung und Datenverarbeitung von Patientendaten
Den deutschlandweit einheitlichen Mustertext der Medizininformatik-Initiative (MII) zur Einwilligung und Datenverarbeitung von Patientendaten (Patienteneinwilligung) finden Sie als PDF-Datei hier.
Im Folgenden erfahren Sie, welche Punkte darin im Wesentlichen enthalten sind.
2.1. Patienteninformation und -einwilligung zur Nutzung von Patientendaten
Das Dokument besteht aus einer 7-seitigen Patienteninformation sowie 4-seitigen Einwilligungserklärung zur Nutzung von Patientendaten (Patienteneinwilligung) [2, 3].
Im Dokument wird erklärt, dass die Einwilligung komplett freiwillig sowie jederzeit widerrufbar ist und den Betroffenen kein Nachteil entsteht, sollten Sie sich dagegen entscheiden [3].
Zudem wird auf den großen Nutzen eingegangen, der durch eine Bereitstellung der Patientendaten für die Forschung mittels Broad Consent entstünde. Es werden Details der Datenverarbeitung dargelegt [3].
Beispielsweise werden einmal erfasste Patientendaten für 30 Jahre ab der Einwilligung gespeichert, sofern kein Widerruf erfolgt. Die Einwilligung in die (erneute) Erhebung muss jedoch alle 5 Jahre erneuert werden [3].
Im Weiteren geht es darum, wie die entsprechenden Patientendaten wissenschaftlich genutzt werden. Hierbei wird der Begriff der Anonymisierung erklärt. Bei einer Weiterverwendung der Daten durch Wissenschaftler:innen sind also keine Rückschlüsse auf die jeweilige Person möglich [3].
Genauso wird der Begriff Codierung nähergebracht. Das heißt, alle unmittelbar eine Person identifizierenden Daten (z.B. Name, Geburtsdatum, Anschrift) werden durch eine Zeichenkombination ersetzt [3].
Es wird betont, dass eine medizinische Datenverarbeitung zu Forschungszwecken ausschließlich in Ländern mit hohem Datenschutzniveau zulässig ist. So wird einem Missbrauch der Daten effektiv entgegengesteuert [3].
Und nicht zuletzt werden die Details zum Umgang mit Krankenkassendaten und Biomaterialien (z.B. Blutproben) dargelegt, welche in bestimmten Fällen ebenfalls relevant für die Patienteneinwilligung sein können [3].
Die Möglichkeiten einer späteren Kontaktaufnahme werden ebenfalls dargelegt [3].
Der Sprung in die Zukunft der medizinischen Forschung ist damit eindrucksvoll gelungen.
Die Inhalte dieses Artikels geben den aktuellen wissenschaftlichen Stand zum Zeitpunkt der Veröffentlichung wieder und wurden nach bestem Wissen und Gewissen verfasst. Dennoch kann der Artikel keine medizinische Beratung und Diagnose ersetzen. Bei Fragen wenden Sie sich an Ihren Allgemeinarzt.
Ursprünglich veröffentlicht am